Este
trabalho foi desenvolvido no então Laboratório de Filarioses e Vetores, da
Coordenação de Ciências da Saúde, do Instituto Nacional de Pesquisas da
Amazônia (INPA) e é reflexo da dissertação de Mestrado (apresentada em 2001) por
Maria Claudete Vasconcelos dos Passos, no Curso de Pós Graduação em Entomologia
(Universidade Federal do Amazonas / Instituto Nacional de Pesquisas da
Amazônia). A referida autora da dissertação foi minha orientanda (V.Py-Daniel).
Foram feitos ajustes no texto, no sentido de apropriá-lo para publicação, tendo
em vista que já fazem 14 anos que o texto original foi desenvolvido, assim, alguns
aspectos referentes com revisões históricas foram mantidos e outros não. Foram
acrescidas algumas bibliografias, tanto no sentido comparativo com a ontogenia
de outras espécies, de diferentes gêneros, como com a de guianense, publicada, em 2015, por Santos-Neto
& Hamada & Couceiro.
ONTOGENIA LARVAL DE Thyrsopelma guianense
(Wise, 1911) (DIPTERA:SIMULIIDAE), NO RIO JAUAPERI, RORAIMA, BRASIL
Passos, M.C.V. dos (1); Py-Daniel,V. (2*); Medeiros,J.F (3); Pessoa,F.A.C. (4).; Barbosa,U.C.(2); Silva,O.S.(2); Junior,E.S.L.(2**)
1 – Universidade Federal de Roraima; 2 – INPA/LETEP
(* - atualmente associado a UnB/ICB/DZ//LEF ** - atualmente no INPE/CRH/DGP); atualmente FIOCRUZ-RO; 4 - atualmente FIOCRUZ-AM
Palavras Chaves: Ontogenia Larval, Simuliidae, Thyrsopelma
guianense, Jauaperi, Roraima.
RESUMO
No
Brasil, vários autores tem contribuído para aumentar o conhecimento sobre os
números de estádios larvais nas espécies Simuliidae. O objetivo deste trabalho
foi determinar o número de estádios para Thyrsopelma guianense (Wise,1911),
descrevendo e ilustrando as possíveis mudanças morfológicas nos diferentes
estádios. As larvas de Thyrsopelma guianense utilizadas
foram coletadas aderidas a macrófitas aquáticas da espécie Mourera fluviatilis
(Podostemaceae), no rio Jauaperi, na localidade Cachoeira Travessão, município
de Rorainópolis, Roraima, Brasil. Essas larvas, ainda no campo, foram
preservadas em álcool 70%. Para determinação do número de estádios larvais de T.
guianense, foram tomadas duas medidas: o comprimento lateral da cápsula
cefálica e a largura do apódema cefálico. Estes dados foram analisados
empregando-se: histograma de freqüência, regressão linear, teste t-Student; Log10,
Regra de Dyar, regra de crescimento de Crosby. Através das análises
estatísticas foram determinados sete estádios larvais, os quais foram
caracterizados, incluindo ilustrações.
INTRODUÇÃO
Os
simulídeos, conhecidos popularmente no Brasil como “pium” e “borrachudo” são
dípteros nematóceros pertencentes a família Simuliidae, com um número de espécies
acima de 2100 (Adler,P.H. & Crosskey,R.W- 2015)
No
Brasil são assinaladas mais de 100 espécies contidas em 15 gêneros: Araucnephia,
Cerqueirellum,
Chirostilbia,
Coscaroniellum,
Ectemnaspis,
Hemicnetha,
Inaequalium,
Kempfsimulium,
Lutzsimulium,
Notolepria,
Psaroniocompsa,
Psilopelmia,
Shelleyellum,
Trichodagmia,
Thyrsopelma.
O
gênero Thyrsopelma (Enderlein, 1934) apresenta atualmente (2015) 10
espécies: duodenicornia (Pepinelli, Hamada & Trivino-Strixino, 2005),
guianense
(Wise, 1911), itaunense (D´Andretta & Gonzalez, 1964), jeteri
(Py-Daniel, Darwich, Mardini, Strieder & Coscarón, 2005), orbitale
(Lutz, 1910), perplexa (Shelley, Maia-Herzog, Dias & Couch, 1983) scutistriata
(Lutz, 1909), nunesdemelloi (Hamada, Pepinelli & Hernández, 2006), litobranchia
(Hamada, Pepinelli, Matos-Gloria & Luz,2010).
Simulium
guianense foi descrita por Wise, em 1911, com
material coletado no Essequibo, na Guiana. D´Andretta & D´Andretta (1945)
trabalhando com material de Piracicaba, Estado de São Paulo, identificado como Simulium
orbitale assinalaram diferenças nos histoblastos branquiais das pupas e
descreveram uma nova espécie, Simulium pintoi. Ramírez-Pérez
(1971) descreveu uma nova espécie, Simulium ortizi, sendo que em 1982,
Ramirez et al., colocaram a mesma como sinônimo de Simulium pintoi. Coscarón
(1987) sugere que Simulium albopictum Lane & Porto, seja sinonimizado com Simulium
pintoi. Shelley et al.
(1997), examinando o material tipo de Simulium pintoi, e comparando com o
material tipo de Simulium guianense, conclui que a primeira é sinônimo de guianense.
Os simulideos são causadores da transmissão de
patógenos para humanos e outros animais em várias partes do mundo, como também
de manifestações alérgicas que são conhecidas como síndromes hemorrágicas.
Também apresentam impacto no mercado econômico em muitas regiões do mundo
(Crosskey, 1990; Merrit & Cummins, 1996). Na região sul do Brasil (Rio
Grande do Sul, Santa Catarina e Paraná) representam problemas no turismo e na
exploração pecuária, além de apresentarem real importância negativa na
produtividade agrícola. Os simulideos determinam prejuízo, portanto de
repercussão negativa, ao nível médico-sócio-econômico (Souza, 1984).
A família Simuliidae, apresenta como uma de suas
maiores importâncias, ao nível de saúde publica, o fato de apresentar espécies
que servem de vetores da filaria Onchocerca volvulus (Leuckart,
1893), causadora da enfermidade conhecida como oncocercose (Cegueira dos rios,
Doença de Robles, Volvulose, Eripsela da Costa, Mal Morado). Outra filaria que
também é transmitida pelos simulideos é a Mansonella ozzardi (Manson, 1897)
causadora de uma das mansoneloses conhecidas. Muitos outros animais (gado,
patos, veado – e outros cervídeos ) também fazem parte do ciclo transmissivo de
outras filarias por simulideos. Além de serem transmissores de nematóides,
também são conhecidos por transmitir vários protozoários para aves, bem como
vírus. Levantamentos epidemiológicos desenvolvidos nos anos de 1994-1997, na
área brasileira do foco oncocercótico trans-fronteiriço (Brasil/Venezuela)
assinalaram que a principal espécie vetora da oncocercose era Thyrsopelma
guianense.
ONCOCERCOSE
A oncocercose é causada pelo helminto da
superfamília Filarioidea, família Onchocercidae). A Onchocerca volvulus
apresenta um ciclo biológico heteroxênico, sendo propagado entre as pessoas
através da picada das fêmeas de algumas espécies de simulideos. No Brasil os
simulideos são conhecidos como “piuns” (região norte) e “borrachudos” (River
Blindness Foundation, 1993).
No Brasil, o primeiro caso assinalado foi
descrito por Bearzoti et al. (1967)
em uma criança com apenas três anos de idade que apresentava dois nódulos
(oncocercomas) no couro cabeludo e que teria adquirido a doença no estado de
Roraima. Py-Daniel (1989) obteve informações que um missionário proveniente do
continente africano, portador da Onchocerca volvulus, viveu no alto
Solimões (Estado do Amazonas) por muito tempo, sendo que o mesmo apresentava
alterações oculares provenientes da oncocercose. O missionário morreu muitos
anos depois ainda com oncocercose. Esta informação indica a presença da oncocercose
no Brasil antes da ocorrência registrada por Bearzoti e colaboradores
(Py-Daniel, 1989; Neves, 1995).
BIOECOLOGIA
A familia Simuliidae é quase cosmopolita, não ocorrendo
apenas em alguns lugares com ausência de águas correntes, como regiões polares
e desertos, apesar de ser encontrada em ilhas e oásis nos desertos, onde a água
corrente é limitada (Shelley, 1994). Ocorre desde o nível do mar até atitudes
acima de 4.000 metros onde a neve e o gelo fundido formam fluxos de água
corrente, e onde exista temperatura suficiente para tornar os ovos viáveis e a
provisão de alimento das larvas seja possível, permitindo assim o
desenvolvimento completo (Merrit & Cummins, 1996).
Em relação às espécies vetoras, existem diferenças
biológicas em função das áreas climáticas, p.ex., entre florestas e savanas,
que influem na densidade populacional, longevidade, raio de ação e poder de
dispersão. Ocorrendo também variações estacionais, o que pode estar diretamente
correlacionado com o ritmo de atividade e potencial transmissivo. Nem todas as
fêmeas de simulideos são hematófagas em humanos, algumas espécies são restritas
para pássaros e outros animais, sendo algumas polífagas. O adulto macho dos
simulideos se alimenta do néctar como fonte de energia. A hematofagia é
exercida pela fêmea principalmente após a cópula, porque requer sangue para a
ovulação. Depois do acasalamento, as fêmeas colocam ovos em uma diversidade de
ambientes, desde que seja lótico (de pequenos córregos a grandes rios) sendo
que a escolha do ambiente varia com a espécie. Cada fêmea apresenta em média
entre 200 e 500 ovos em um único ciclo gonadotrófico, depositando os ovos na
superfície da água que posteriormente ficam aderidos em algum substrato.
Dependendo da espécie e fatores ambientais como temperatura da água, o período
de incubação varia de 2 a 30 dias, podendo se prolongar caso a espécie
apresente diapausa. A eclosão da larva ocorre cerca de quatro dias nos meses de
verão, sendo que no inverno pode ocorrer um retardamento da eclosão. A larva
apresenta uma ventosa na extremidade posterior, com a qual se fixa no substrato
escolhido. Geralmente podem ser observadas dezenas de larvas “atapetando” uma
pedra, parecendo lodo espesso. A larva pode permanecer no local onde ocorreu a
eclosão se o substrato e a provisão de alimento forem adequados e suficientes
para ela, caso contrário, podendo sair vagueando a jusante em “fios de seda” à
procura de locais que satisfaçam suas necessidades. As larvas de alguns tipos
de simulídeos geralmente encontram-se associadas à macrófitas aquáticas da
família Podostemaceae, como por exemplo, Mourera fluviatilis, que formam
associações sobre rochas e crescem ao longo das corredeiras / cachoeiras,
firmemente aderidas por meio de estruturas e secreções de substâncias que
auxiliam na fixação ao substrato. A espécie Mourera fluviatilis, na
Amazônia, durante a estação chuvosa desenvolve as partes vegetativas e com a
diminuição dos níveis de água emitem flores que produzem grandes quantidades de
sementes. Na fase reprodutiva apresenta suas partes florais acima do nível das
águas e sua folhagem submersa, essa variação temporária ou sazonal tem efeito
importante sobre a ecologia e a biologia dessas plantas. Em ambientes com
declives suaves e bom arejamento, essas plantas podem se apresentar
substancialmente maiores, com área foliar mais larga e consistente, bem como
flores e frutos maiores, como por exemplo, Rhyncholacis linearis que registra
40 cm de comprimento, porém em condições ótimas chegam até 140 cm de
comprimento (Tavares, 1997).
As larvas dos simulídeos apresentam uma série de
mudas (4-9 mudas, mas geralmente sete). As taxas de crescimento flutuam
dependendo da temperatura da água e quantidade e disponibilidade de alimento,
após as mudas, secretam um casulo que é fixado firmemente e transformam-se em
pupas, sendo que a duração da fase pupal também varia de acordo com a
temperatura da água, mas, geralmente é de 2 a 7 dias, podendo em certas circunstâncias
duas ou três semanas. Quando o adulto estiver pronto para emergir, sai da pupa,
deixando um “T”. Nasce debaixo da água, envolvido em uma bolha de ar que sobe
até a superfície e estoura liberando o simulideo, que voa e procura um ponto
para aguardar o endurecimento da cutícula. Depois de acasalar, procura uma
fonte satisfatória de sangue, e todo o ciclo de vida começa novamente. O número
de gerações anuais varia de acordo com a espécie e é influenciado por fatores
geográficos e climáticos. Em áreas tropicais, podem ocorrer de 16 a mais
gerações, nas regiões temperadas podem haver seis gerações; em ambientes como o
Ártico, normalmente uma única ou mesmo duas gerações (Rey, 1992; Neves, 1995;
Merrit & Cummins, 1996).
No estágio larval o número de estádios pode variar
dentro de uma espécie, assim como altas temperaturas da água podem diminuir o
tempo de desenvolvimento. O número de estádios e tamanho da larva, na
maturidade, são extremamente variáveis
(Ross & Merrit, 1978). Vários autores estudaram o número de estádios
larvais de simulideos e encontraram uma variação de 4 a 9 estádios. Ross &
Merrit (1978) listaram os autores e os números de estádios que eles encontraram
em Simuliidae e somente Smith (1969 apud
Ross & Merrit, 1978) encontrou 8 estádios larvais. Os demais acharam
espécies com 4, 6, 7 e 9 estádios larvais, sendo que 7 estádios foi o número
mais comumente encontrado (Gorayeb, 1981).
Existem alguns estudos efetuados procurando
correlacionar os estádios a biometria das larvas, diferenças morfológicas,
biologia e ecologia, dos quais citamos os de sete estádios larvais de Prosimulium
mixtum Syme & Davies e Prosimulium fuscum Syme &
Davies, onde foram analisadas larvas de um trecho do rio Michigan, durante o
outono de 1976, no qual utilizaram o teste T-Student para verificar a precisão
do número de estádios larvais, confirmados pela aplicação da Regra de
Crescimento de Crosby (Craig, 1975); Simulium venustum também foi
estudado para determinação do numero de seus estádios larvais, onde o mesmo apresentou
seis estádios larvais (Mokry, 1976); as espécies Prosimulium fuscum Syme
& Davies, Prosimulium mixtum Syme & Davies apresentaram sete
estádios; Simulium vittatum Zettersted e Stegopterna mutata
(Malloch) com seis e sete estádios respectivamente, e Cnephia dacotencis, que
não foi possível distinguir, com certeza, o número de estádios larvais (Ross
& Merrit, 1978).
A principal espécie vetora de Onchocerca volvulus
(Leuckart, 1893) na Amazônia é Thyrsopelma guianense, presente
durante o ano todo e sendo mais numerosa na variação sazonal de vazante para
seca; é predominante em regiões montanhosas de muitos rios dos Escudos do
Brasil Central e das Guianas, onde a preferência tópica para as fêmeas picar é
da cintura para baixo, mais especificamente na região perna/pé e
secundariamente nas coxas (Py-Daniel, 1997; Py-Daniel et al., 1999).
OBJETIVOS
GERAL – Obter dados referentes á morfologia larval
para proporcionar futuros estudos filogenéticos e biogeográficos em Thyrsopelma.
ESPECÍFICO – Assinalar o número de estádios
larvais de Thyrsopelma guianense (Wise, 1911). Analisar as possíveis
variações morfológicas dentro dos estádios larvais encontrados, e procurar
detectar se existem novos caracteres que possam auxiliar na taxonomia do
gênero.
MATERIAL
E MÉTODO
Área
de Estudo
O material utilizado para este estudo foi coletado
no rio Jauaperi, localidade denominada de Cachoeira Travessão (0o28´48”
N / 060o29´49” O), estado de Roraima (Figura 1). Nesta localidade a espécie
de maior grau de antropofilia, foi T. guianense, com maior incidência
de adultos na época da variação sazonal de vazante para seca, e confirmando que
as preferências tópicas para o hematofagismo no ser humano são da cintura para
baixo (Py-Daniel, 1997; Py-Daniel et al.,
1999). O acesso ao local de trabalho foi feito por propriedade particular,
adentrando uma porteira, onde no local exista uma pastagem, seguindo por mata
primária até as margens do rio Jauaperi, na cachoeira Travessão. A distância da
porteira ao local de coleta foi de 5 km.
Figura
1 – Trecho de mapa do Estado de Roraima, mostrando o local de coleta. Mapa
elaborado pela Secretaria de Planejamento, indústria e Comercio - SEPLAN, do
Governo de Roraima.
Coletas
das larvas
As larvas foram coletadas no mês de novembro de
1999, sendo o período de seca no rio Jauaperi. O material recolhido na
cachoeira constou de macrófitas aquáticas (Podostemaceae) submersas, sendo
necessária a utilização de tesoura, além da força física para a extração das
plantas do substrato rochoso no qual ficam aderidas. Estas plantas estavam no
seu período de floração, onde foram observados os estróbilos floridos expostos
acima do nível das águas, muitos deles secos sob as rochas, repletos de
sementes. O material utilizado neste estudo foi obtido das porções submersas
(ainda verdes), nas quais as larvas dos simulideos ficam aderidas (Figura 3). As
plantas foram coletadas e acondicionadas em sacos plásticos de 18 litros. Foram
coletadas duas espécies de podostemaceas neste ambiente. Aos sacos plásticos contendo
as plantas foi acrescentado álcool 70%, sendo os mesmos transportados para o
Laboratório de Filarioses e Vetores (LFV) do INPA (Figura 2).
Figura 2 – Coleta manual e acondicionamento das
podostemaceas em sacos plásticos.
Figura 3 – Macrófita (Podostemaceae) submersa, com
estróbilos expostos.
Análises
em laboratório
Triagem
Inicial
As macrófitas foram retiradas dos sacos plásticos e
colocadas em bandejas plásticas de fundo branco, sendo o trabalho inicial
especificamente para extrair todo o material entomológico (fauna associada,
ovos-larvas-pupas-exúvias de simulídeos) das folhas (limbo, pecíolo, bainha). O
material retirado das macrófitas foi acondicionado em frascos de vidro com
capacidade de 500 ml e imersos em álcool 70%.
Triagem
da Fauna Associada e simulídeos
Este material passou por uma triagem seletiva,
separando a entomofauna associada (ao nível de ordem) e os simulídeos tanto ao
nível específico e como os estágios de T. guianense.
Triagem
das larvas de T.guianense por tamanho
Utilizou-se o papel milimetrado, tendo como base o
número de quadrados, onde foram obtidos inicialmente 12 tamanhos diferentes de
larvas. Nesta fase foi triado um número abundante de larvas para serem
utilizadas no trabalho.
Biometria
Larval
Após a obtenção de 12 amostras de larvas de
diferentes tamanhos, foram tomadas as medidas do corpo, pós-genae (comprimento
lateral da cápsula cefálica) e o apodema cefálico. Sendo medidas 50 larvas de
cada vidro (com 600 larvas medidas no total). Para esta fase utilizou-se uma
placa de Petri pequena, contendo areia filtrada no fundo, com álcool suficiente
para cobrir a areia. Nas larvas de menor tamanho, o material colocado no fundo
da placa, foi o algodão umedecido com álcool. Os valores biométricos de cada
larva foram devidamente anotados em uma ficha que continha o número do vidro ao
qual a larva pertencia (de 1 a 50), o seu número de identificação, o valor (do
corpo/pós genae/apódema) e a ocular ao qual foi medida. Para as medições de
tamanho, foram utilizados diferentes aumentos de oculares micrométricas, ou
seja, para larvas maiores a ocular (mm) foi de aumento 9x e para as larvas
menores a ocular (mm) de 20x. As larvas
após a obtenção dos dados, foram acondicionadas individualmente em tubos
de vidro, etiquetadas, e imersas em álcool 70%, para posterior montagem em
lâmina/lamínula. A verificação das medidas do comprimento do pós-genae
(comprimento lateral da cápsula cefálica, indo da base da inserção do leque
cefálico até o ápice posterior da cabeça, e a largura do apódema cefálico
(Figura 4), foram feitas com base na metodologia utilizada por Gorayeb (1981),
Hamada (1989), Alencar (1998) e Cunha et
al. (1998).
Figura 4 – Estruturas medidas da cabeça de T.
guianense para determinar o número de estádios larvais. A) Comprimento
lateral da cápsula cefálica, B) Largura do apódema cefálico.
As medidas do comprimento lateral da cabeça e a
largura do apódema cefálico foram anotadas em uma planilha para a realização
posterior dos tratamentos estatísticos. Para a comparação dos testes foram
utilizados os programas Systat 5.0 e o Bioestat. Os gráficos de freqüência,
Dispersão e Log10 foram confeccionados no programa Excell 97.
Para determinação do número de estádios, os dados
obtidos dos dois parâmetros examinados (comprimento lateral da cabeça e largura
do apódema cefálico), foram colocados em gráficos de distribuição de
freqüências, onde o limite entre um estádio e outro foi definido entre os
valores mínimos e máximos, ocasionando “picos”, separando um estádio do outro
(Gorayeb, 1981; Hamada, 1989).
A precisão do agrupamento dos estádios larvais foi
determinada através da regra de crescimento de Crosby, a qual propõe que se as
diferenças entre duas razões consecutivas de Brook (razão de Brook = MA+1 / MA,
onde MA+1 = média da medida do parâmetro do estádio posterior e MA = média da
medida do parâmetro anterior) for maior do que 10% da razão de Brook anterior
(diferenças obtidas através da fórmula BA+1 – BA / BA x 100, onde BA+1 = razão
de Brook posterior e BA = Razão de Brook anterior) existe possibilidade de
ter-se perdido um estádio (Craig, 1975).
As médias do comprimento lateral da cabeça e da
largura do apódema cefálico também foram analisadas pelo teste T-Student, no
sentido de verificar as diferenças entre as mesmas (significativas ou não)
(Ross & Craig, 1979; De Moor, 1982; Hamada, 1989; Alencar, 1998, Cunha et al., 1998).
Para verificação do crescimento geométrico foi
utilizado o logaritmo na base 10 das médias do comprimento lateral da cabeça e
da largura do apódema cefálico de cada estádio larval. Para a observação de
qualquer desvio nos estádios, foi utilizada uma análise de regressão linear,
verificando a dispersão dos valores na reta. Segundo a Regra de Dyar, caso
ocorra algum desvio significativo, isto indica que algum estádio foi perdido
(Dyar, 1890; Wigglesworth, 1961; Ross & Merrit, 1978; Ross & Craig,
1979; De Moor, 1982).
Análise
morfométrica dos estádios
As estruturas das larvas foram fotografadas no
laboratório da COPEQ, com auxilio de um microscópio AXIOPLAN2/ZEISS, com câmera
fotográfica acoplada - modelo DATABACK D4 e utilizado filme colorido KODAK
ULTRA400 (35mm) e FUJIFILM AGFA APX25 para fotos em preto e branco. Em cada
lâmina analisada as estruturas, foram descritas e fotografadas.
RESULTADOS
E DISCUSSÃO
Determinação
Biométrica dos números de estádios
No Brasil, alguns autores contribuíram, nos estudos
de larvas, com a descrição de estádios, como: Gorayeb (1981) que detectou 8
estádios larvais para Simulium fulvinotum (= Ectemnaspis
rorotaense); Hamada (1989) para Simulium goeldii (= C.
goeldii); Alencar (1998) para Simulium perflavum (= Ectemnaspis
perflava), com 7 estádios; Alencar, Hamada & Magni-Darwich (2001). Cunha
et al. (1998), para Simulium
(C.) pertinax (= Chirostilbia
pertinax), S. (C.) acarayense (= Chirostilbia subpallida), S.(T.)
orbitale
(=Thyrsopelma
orbitale) com sete estádios e para S.(P.) incrustatum (= Psaroniocompsa
incrustata) com oito estádios. Alvan-Aguilar & Hamada (2003), para Simulium
rubrithorax (= Hemicnetha rubrithorax) com 7
estádios. Andrade,
Strixino, Py-Daniel & Medeiros (2004) para Hemicnetha brachyclada,
com 7 estádios. Silva,A.N.B (2006), para Psaroniocompsa incrustata, com 7
estádios. Santos-Neto; Hamada,N. & Couceiro (2015) para Simulium
guianense (= Thyrsopelma guianense), com 6
estádios.
No nosso
trabalho os histogramas de distribuição de freqüências das medidas de
comprimento lateral da cápsula cefálica e do comprimento da largura do apódema
cefálico apresentaram 6 estádios. O número de estádios foi contado a partir do
segundo, por que o primeiro estádio não foi considerado no histograma, devido a
existência de somente um exemplar, sendo assim, apenas considerado na
contagem geral do número de estádios. Portanto,
as larvas de T. guianense
apresentaram sete estádios (Figuras 5 e 6).
Os
valores das médias utilizadas demonstraram uma diferença ( p < 0,001 ) entre
um estádio e outro (Tabelas 1 e 2).
No diagrama de dispersão, a correlação existente,
onde Y=7,76+0,98, R2=0,96 e n=600, sugere que os valores seguem uma
seqüência geométrica de crescimento, e que os valores encontrados são próximos,
e que a maioria dos valores ocasionou uma sobreposição dos mesmos em algum
estádio (valores de medidas entre o comprimento lateral da cápsula cefálica e o
comprimento da largura do apódema cefálico), onde os estádios encontrados seguem uma seqüência linear, altamente
correlacionada (Figura 7).
Para
verificação de crescimento geométrico, foi utilizada a regra de Dyar (Wiggleshworth,
1961) que relaciona a quantidade de crescimento como também os intervalos entre
os estádios. Implica no crescimento geométrico de uma parte do corpo (cápsula
cefálica e apódema), aumentando os valores a cada muda, de modo que o
crescimento permanece constante para uma determinada espécie. Para verificação
da forma e taxa de crescimento durante um estádio larval, os valores das médias
de cada parâmetro medido em cada estádio, foram transformados em logaritmo
(base 10) e plotados contra o número de estádios que a larva apresentou, para obtenção
de uma reta.
O
método foi utilizado para as médias de comprimento lateral da cápsula cefálica
e do comprimento da largura do apódema das larvas, obtendo as seguintes retas
(Log10Y=1,64+0,50, r2 = 0,99 e n=6) para o comprimento lateral da
capsula cefálica e (Log10Y=1,43+0,59, r2 = 0,97 e n=6)
para o comprimento da largura do apódema cefálico, indicando um crescimento geométrico (Figuras 8 e 9).
Também
foi utilizada a regra de crescimento de Crosby, onde valores maiores que 10%
(obtidos da divisão do comprimento da cápsula cefálica de um estádio anterior
para um posterior) indicam que pode ter ocorrido perda de um estádio (Craig,
1975).
A
razão de Brook encontrada para o comprimento lateral da cápsula cefálica mostra
que todos os valores foram maior que
10%, e que a para o comprimento da largura do apódema cefálico dois valores
maiores foram obtidos, Não é o primeiro caso de valores acima do que é
permitido a regra, como demonstra Alencar (2001) citando estudos com Simulium
oviceps, onde ocorreu um crescimento anômalo dos artículos antenais. Não foi observado este crescimento anômalo
para T. guianense, sugerindo assim
exame mais crítico das medidas atuais, para que se possam explicar tais
percentuais.
Figura 5 – Histograma de freqüência de larvas de Thyrsopelma guianense (Wise, 1911) em relação às medidas do comprimento lateral da cápsula cefálica.
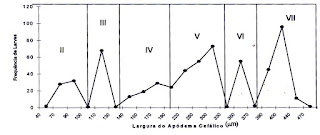
Figura 6 - Histograma de freqüência de larvas de Thyrsopelma guianense (Wise,1911), em relação às medidas de largura do comprimento do apódema cefálico.
Figura 5 – Histograma de freqüência de larvas de Thyrsopelma guianense (Wise, 1911) em relação às medidas do comprimento lateral da cápsula cefálica.
Figura 6 - Histograma de freqüência de larvas de Thyrsopelma guianense (Wise,1911), em relação às medidas de largura do comprimento do apódema cefálico.
Figura 7 – Reta de Regressão das medidas do
comprimento lateral da cápsula cefálica (m) com as medidas do
comprimento da largura do apódema cefálico (m) das larvas de Thyrsopelma
guianense (Wise, 1911) e as delimitações de cada estádio.
Tabela
1 – Média das medidas do comprimento lateral da capsula cefálica (mm) de larvas de T. guianense. [n =
tamanho da amostra; t = Teste t-Student aplicado nas médias de dois estádios
consecutivos; * = p < 0,001; % R. de Brook = Porcentagem da diferença entre
duas razões de Brook consecutivas].
Tabela
2 – Média das medidas do comprimento da largura do Apódema Cefálico (mm) de larvas de T. guianense. [n =
tamanho da amostra; t = Teste t-Student aplicado nas médias de dois estádios
consecutivos; * = p < 0,001; % R. de Brook = Porcentagem da diferença entre
duas razões de Brook consecutivas].
Os números obtidos nas medições do comprimento
lateral da cápsula cefálica e do comprimento da largura do apódema cefálico,
mostraram que para T. guianense, os valores
do apódema foram similares às medidas de comprimento lateral da capsula
cefálica e que em algum estádio de crescimento largura do apódema e comprimento
lateral da capsula cefálica tiveram a mesma medida, como nos estádios II
(valores 70 e 90 mm), V (valores 260 e 300 mm)
e estádio VI (valor 350 mm), respectivamente Tabelas 3 e 4).
A determinação de sete estádios pelos quais
passam as larvas de T. guianense mostram um padrão similar ao encontrado por Cunha et al. (1998) em outra espécie do gênero
Thyrsopelma
(T.
orbitale).
Figura
8 – Regressão Linear do Log10 das médias do comprimento lateral da
cápsula cefálica, contra os respectivos estádios larvais.
Figura
9 – Regressão Linear do Log10 da médias do comprimento de largura do
Apódema Cefálico, contra os respectivos estádios larvais.
Tabela
3 – Valores brutos transformados (mm - mm)
e freqüência do comprimento lateral da capsula cefálica de T. guianense.
Tabela
4 – Valores brutos transformados (mm - mm)
e freqüência do comprimento da largura do Apódema Cefálico de T.
guianense.
Descrições
dos estádios larvais
Larva
de primeiro estádio – Cabeça mais larga que o tórax. Leque
cefálico com 12 raios e sem microtríquias aparentes. Antena uni-segmentada,
mais longa que o comprimento da base do leque cefálico, com sensila cônica n na
extremidade e sem estriações. Haste do leque cefálico aparentemente pouco
esclerotizada. Dois pares de estemas visíveis, sendo o estema distal menor que
o proximal, em relação ao corpo, ambos os estemas com formato mais ou menos
circular. Abdome delgado, entumecido na extremidade posterior e sem escamas. Disco
anal com três ganchos por fileira (Figuras 10 a 13).
Figura 10 – Primeiro estádio larval - larva
eclodida, extremidade posterior (100x)
Figura 12 - - Primeiro estádio larval – Ganchos das fileiras do Disco Anal (100x)
Figura 13 - - Primeiro estádio larval – Disco Anal (100x)
Larva de segundo estádio – Cabeça: Setas frontais situadas na região
supra-mandibular. Inseridas logo acima da base do dente apical, não
ultrapassando o ápice do dente apical, presença de escova adoral. Antena com
dois segmentos bem definidos, uma sensila cônica na extremidade distal, o
primeiro segmento antenal menor do que a haste do leque cefálico. Leque
cefálico com 16 raios, e microtríquias, curtas, esparsas e desalinhadas.
Mandíbula contendo 1 dente apical fortemente esclerotizado e 5 dentes internos,
sendo 3 dilatados e 2 delgados, dente basilar bífido ausente. Hipostômio com 6
dentes. Abdome: Ápice do pseudópodo torácico com 3 a 4 ganchos por fileira.
Disco anal apresentando 5 ganchos por fileira (Figuras 14 a 17).
Figura 14 – Segundo estádio larval – Pseudópodo
torácico (100x)
Figura 15 – Segundo estádio larval – Ganchos do Disco Anal (100x)
Figura 16 - Segundo estádio larval – Antena (100x)
Figura 17 - Segundo estádio larval – Raios do Leque Cefálico (100x)
Larva de terceiro estádio – Cabeça: Leque cefálico com 22 raios
filiformes, sem manchas e não diferenciados; Mandíbula com escova adoral
contendo setas anteriores curtas e setas posteriores longas; 1 dente apical e 6
dentes internos. Sendo 3 dilatados e com ápices voltados para a área posterior
da mandíbula e 3 delgados e não curvados; dente basilar não bífido, e dente externo
supra mandibular; Hipostômio com 9 dentes, sendo que os 4 laterais são do mesmo
tamanho e o dente central mais proeminente que os demais, dentes de formato
cônico e muito esclerotizados na porção apical. Antena com 2 segmentos, e
ultrapassando a haste do leque cefálico (HLC). Abdome: Ápice do pseudópodo
torácico com 4-5 ganchos por fileira. Disco anal com 8 ganchos por fileira (Figuras 18 a 23).
Figura 18 - Terceiro estádio larval – Antena e haste
do Leque Cefálico (HLC) (100x)
Figura 19 - Terceiro estádio larval – Leque Cefálico
(40x)
Figura 20 - Terceiro estádio larval – Mandíbula,
dentes e Escova Adoral (100x)
Figura 21 - Terceiro estádio larval – Hipostômio (100x)
Figura 22 - Terceiro estádio larval – Pseudópodo
torácico (40x)
Figura 23 - Terceiro estádio larval – Ganchos do Disco Anal (100x)
Larva de quarto estádio – Cabeça: Leques cefálicos sem manchas e com
microtríquias de tamanho médio, distante uma das outras. Mandíbula com 8 dentes
internos, sendo 3 dentes robustos, 5 medianos (3 maiores e 2 menores), ponta do
dente basilar bífida e em processo de crescimento, ponta próxima aos dentes
medianos maior em relação à outra, setas frontais presentes, 1 dente externo
acima do dente apical. Escova adoral com muitas setas filiformes, setas
anteriores curtas e setas posteriores longas. Antena com 3 segmentos.
Hipostômio com 9 dentes, sendo 1 dente central, 2 dentes pontas isométricos,
3+3 dentes intermediários (entre os dentes pontas e o central) com mesmo
tamanho e forma; dente interno central do hipostômio mais esclerotizado que os
demais; com 1 fileira de setas hipostomiais, número de setas por fileira igual
a 3. Abdome: escamas petaliformes restritas e escassas, esparsas e restritas à
área dos tergitos posteriores; 8 ganchos por fileiras no pseudópodo torácico.
Com 11-12 ganchos por fileira no disco anal; esclerito anal em forma de X, com
braços anteriores menores que os braços posteriores, unidos na porção basilar
(estádio não fotografado).
Larva de quinto estádio - Cabeça: Antena com 3 segmentos, o último
artículo com sensila cônica. Esclerito labral com 2+2 dentes anteriores. Escova
adoral com setas anteriores mais curtas que as posteriores; dentes pontas
hipostomiais com uma projeção lateral, apresentando uma certa bifurcação; Hipostômio
com 9 dentes, sendo 1+1 pontas, 1 dente central do mesmo tamanho e forma que os
6 intermediários, sendo que os dentes pontas e central são mais expandidos e
robustos que os dentes intermediários, que são delgados; 3 setas hipostomiais
por fileira, na região lateral. Fenda Gular profunda e maior do que a Ponte
Pré-Gular. Microtríquias do Leque Cefálico mais numerosas que nos dois
primeiros estádios, filiformes, simples e sem repartições, Leques Cefálicos sem
manchas; Mandíbula com 6 dentes internos, sendo 3 pré-apicais (2 mais
expandidos, curvo e 1 menos expandido e não curvo, 2 dentes externos, dente
basilar da mandíbula não bífido, de ápice retilíneo. Presença de 2-4 setas
frontais supra mandibulares. Abdome: Disco anal com 11 ganchos por fileira;
ausência parcial de escamas petaliformes no corpo, quando presentes, inseridas
nos tergitos, restritas à área perto do esclerito anal. Ápice do pseudópodo
torácico com 7-8 ganchos por fileira (Figuras 24 a 27).
Figura 24 – Quinto
estádio larval – Antena (40x)
Figura 25 - Quinto
estádio larval – Fileiras de ganchos do Disco Anal (100x)
Figura 26 - Quinto
estádio larval – Ápice mandibular, Dente Apical e Dentes Internos (100x)
Figura 27 - Quinto
estádio larval – Raios do Leque Cefálico, e microtríquias filiformes (100x)
Larva
de sexto estádio – Cabeça: Leque cefálico com 34 raios e
microtríquias abundantes; antena com 3 segmentos; esclerito labral com 2+2
dentes anteriores; mandíbulas com 1 dente apical fortemente esclerotizado, com
8 dentes internos, sendo os 3 internos anteriores mais robustos que os outros;
dente basilar bífido; hipostômio com 9 dentes muito esclerotizados, dente
central e os dos pontas do mesmo tamanho, borda dos dentes simples, dente
próximo ao dente ponta com curvatura voltada para a região central do
hipostômio, os dois dentes pontas maiores, retilíneos e mais pontiagudos que os
demais, 4 setas hipostomiais por fileira, de tamanho decrescente em relação a
base do hipostômio. Abdome: Disco anal apresentando 19 ganchos por fileira,
esclerito anal em forma de “X”, com braços esclerotizados. Escamas petaliformes
esparsas, inseridas nos tergitos, restritas à porção posterior da larva e
localizadas mais próximas ao esclerito anal (Figuras 28 a 33).
Figura
28 – Sexto estádio larval – Vista
dorsal da Cápsula Cefálica, com Antenas, Leques Cefálicos, Esclerito Labral
(20x)
Figura 29 - Sexto estádio larval – Porção
apical da Cápsula Cefálica, mostrando os raios do Leque Cefálico e Esclerito Labral (20x)
Figura
30 - Sexto estádio larval – Ápice da Mandíbula, apresentando os dentes internos, apical e externos (100x).
Figura 31 - Sexto
estádio larval – Hipostômio (40x)
Figura 32 - Sexto estádio larval – Fileiras de
ganchos do Disco Anal (100x)
Figura 33 - Sexto
estádio larval – Esclerito Anal e Disco Anal (20x)
Larva de sétimo estádio – Cabeça: Leque cefálico com 36 raios,
microtríquias em maior número que no estádio anterior, presentes em toda a
extensão do raio, exceto na região basilar, filiformes. Raios do leque cefálico
filiformes, sem diferenciação. Esclerito labral com 2+2 dentes. Fenda Gular
profunda. Hipostômio com 9 dentes esclerotizados, sendo os dentes internos
intermediários menores que os internos externos, dente intermediário externo
com inserção no dente ponta, presença de 4+4 setas hipostomiais filiformes,
sendo 3 maiores. Mandíbula com 1 dente apical muito exclerotizado, 9 dentes
internos, sendo os 3 distais robustos e curvos, e os 2 médios e 4 posteriores
delgados. Dente basilar bífido, sendo o mais anterior maior; presença de dois
dentes externos, presença de 3 setas frontais.Corpo: Tergitos bastante
diferenciados, com presença de escamas petaliformes distribuídas ao longo dos
mesmos. Ápice do pseudópodo com ganchos por fileira variando em entre 12-13. Disco
Anal com 19 ganchos por fileira, esclerito anal em forma de “X”, sendo os
braços anteriores mais curtos que os posteriores (Figuras 34 a 42).
Figura 34 - Sétimo
estádio larval – Hipostômio (40x)
Figura 35 - Sétimo
estádio larval – Histoblasto branquial, Pseudópodo torácico (20x)
Figura 36 - Sétimo
estádio larval – Histoblasto branquial aberto (10x)
Figura 37 - Sétimo
estádio larval – Fileiras de ganchos do Pseudópodo torácico (100x)
Figura
38 - Sétimo estádio larval – Escamas
petaliformes inseridas nos tergitos (100x)
Figura 39 - Sétimo
estádio larval – Ápice mandibular (100x)
Figura 40 - Sétimo
estádio larval – Raios do Leque Cefálico e microtríquias (100x)
Figura 41 - Sétimo
estádio larval – Esclerito Anal (em forma de “X” e Disco Anal) (20x)
Figura 42 - Sétimo
estádio larval – Fileiras de ganchos do Disco Anal (100x)
CONCLUSÕES
As larvas de Thyrsopelma
guianense (Wise, 1911) apresentaram sete estádios.
Devido à Razão de Brook
ser maior que 10% e observando que este não é o primeiro trabalho que isto
ocorreu, é sugerido que a metodologia, para determinação de crescimento de
estruturas esclerotizadas, seja revista.
Foi observado que as
estruturas que mais se diferenciaram foram: Leques cefálicos (raios e
microtríquias), mandíbula, hipostômio, número de artículos antenais, número de
ganchos do pseudópodo torácico, número de ganchos do disco anal,
presença/ausência das brânquias torácicas (histoblastos branquiais),
aparecimento da distinção dos tergitos, forma do esclerito labral, forma do
esclerito anal.
A população Thyrsopelma guianense do rio Jacaré,
no Estado do Piauí, estudada por Santos-Neto et al. (2015) apresentou o estágio larval com 6 estádios, diferente
do número encontrado por nós para a população do rio Jauaperí, no Estado de
Roraima, assim, para o gênero Thyrsopelma atualmente existem dois
números de estádios descritos: (T. orbitale = 7 estádios; T.guianense
= 6-7 estádios).
REFERÊNCIAS
BIBLIOGRÁFICAS
ADLER,P.H. &
CROSSKEY,R.W (2015) – World Blackflies (Diptera:Simuliidae): A Comprehensive
Revision of the Taxonomic and Geographical Inventory. 123
pp. (www.clemson.edu/cafls/biomia/pdfs/blackflyinventoroty.pdf)
ALENCAR,Y.B. (1998) – Alimentação e determinação
biométrica de larvas de Simulium perflavum Roubaud, 1906
(Diptera:Simuliidae) em igarapés na Amazônia Central, Brasil. Dissertação de
Mestrado, Instituto Nacional de Pesquisas da Amazônia – Universidade Federal do
Amazonas, Manaus, Amazonas, 146p
.
ALENCAR,Y.B.;
HAMADA,N. & MAGNI-DARWICH,S. (2001) – Morphometric comparison of Simulium
perflavum larvae (Diptera:Simuliidae) in relation to season and gender
in Central Amazonia, Brazil. Mem.Inst.Oswaldo Cruz 96(6):785-789.
ALVAN-AGUILAR,M.A.
& HAMADA,N. (2003) – Larval biometry of Simulium rubrithorax
(Diptera: Simuliidae) and size comparison between populations in the states Minas Gerais
and Roraima, Brazil. Mem. Inst. Oswaldo Cruz 98(4): 507-511.
ANDRADE,H.T.A.; STRIXINO,S.T.; PY-DANIEL,V.;
MEDEIROS,J.F. (2004) – determinação dos estádios larvais de Hemicnetha
brachyclada (Lutz & Pinto) (Diptera: Simuliidae). Entomologia y
Vectores 11(3): 541-550.
BEARZOTI,P; LANE,E. & MENEZES,J. (1967) – Relato
de um caso de oncocercose adquirida no Brasil. Rev.Paul.Med. 70:102.
COSCARÓN,S. (1987) – El género Simulium Latreille en la
Región Neotropical. Análisis de los grupos supraespecíficos, espécies que los
integram y distribuición geográfica (Simuliidae: Diptera). Belém, MPEG, coleção
Emile Snetheage, 111p.
CRAYG,D.A.
(1975) – The larvae of Tahitian Simuliidae (Diptera:Nematocera). J.Med.Entomol.
12: 463-476pp
CROSBY,T,K,
(1974) – Life history stages and Taxonomy of Austrosimulium (Austrosimulium) tikkyardianum (Diptera: Simuliidae). N.Z.J. Zool. 1: 5-28.
CROSSKEY,R.W.
(1990) – The Natural History of Blackflies. Ix+711pp. John Wiley.
CUNHA,M.C.I.; COSCARÓN,S.; BASSI,R.M.A. (1998) –
Determinación de los estádios larvales de Simulium (Diptera:Simuliidae) de
Paraná, Brasil. Acta Biol.
Par., Curitiba, 27 (1,2,3,4): 57-66.
D´ANDRETTA,M.A.V. & D´ANDRETTA,C. (1945) – As
species neotropicais da familia Simuliidae Schiner, 1864 (Diptera-Nematocera). I.
Simulium
(Eusimulium)
orbitale
Lutz,1910; Simulium (Eusimulium) pintoi n.sp. e Simulium
nigrimanum Macquart, 1837, sp. inquirendae.
Mem.Inst.Oswaldo Cruz 43(1):85-152.
DE MOOR,F.C.
(1982) – Determination of the number of instars ande size variation in the larval
and pupae of Simulium chutteri Lewis,1965 (Diptera:Simuliidae) and some
possible bionomical implications. Can.J.Zool. 60: 1374-1382.
DYAR,H.G. (1890)
– The number of molts lepidopterous larvae. Psyche (5): 420-422.
GORAYEB,I.S. (1981) – Comportamento de ovoposição e
ciclo evolutivo de Simulium fulvinotum Cerqueira & Mello, 1968. (Diptera:
Nematocera). Acta Amazônica, 11(3): 595-604.
HAMADA,N. (1989) – Aspectos bioecológicos de larvas
de Simulium
goeldii Cerqueira & Nunes de Mello, 1967, com referências a larvas
de Simulium
rorotaense Floch & Abonnenc, 1946 (Diptera:Simuliidae) na Reserva
Florestal Ducke, Amazônia Central. Dissertação de Mestrado, Instituto Nacional
de Pesquisas da Amazônia – Universidade federal do Amazonas, Manaus, Amazonas,
106p.
MERRIT,R.W.
& CUMMINS,K.W. (1996) – Aquatic Insects of North America. Third Edition,
USA (cap. 25): 591-633.
MOKRY,J.E.
(1976) – Laboratory studies on the larval biology of Simulium venustum Say
(Diptera:Simuliidae), Can.J.Zool. 54: 1657-1663.
NEVES,D.P. (1995) – Parasitologia Humana. 9a
Edição. Editora Atheneu. São Paulo-Rio de Janeiro. 524p.
PY-DANIEL,V. (1989) – Oncocercose no Solimões.
Rev.Saúde Públ., São Paulo, v. 23, p.260.
PY-DANIEL,V. (1997) – Oncocercose, uma endemia focal
no hemisfério norte da Amazônia in:
Barbosa,R.I.; Ferreira,E.J.G.; Castellón, E.G. (eds.). Homem, Ambiente e
Ecologia no Estado de Roraima, Manaus, INPA, pp: 111-155, 613pp.
PY-DANIEL,V.; PASSOS,M.C.V.; MEDEIROS,J.F.;
ANDREAZZE,R. (1999) – Dinâmica da Atividade hematofágica (preferências horárias
– tópicas) e estado reprodutivo das fêmeas de Thyrsopelma guianense
(Wise,1911) (Diptera, Culicomorpha,Simuliidae), principal vetor da filaria Onchocerca
volvulus (Leuckart, 1893) no Brasil. Entomologia y Vectores, vol. 6(4):
339-360.
RAMIREZ-PEREZ,J. (1971) – Distribuición geográfica y
revisón taxonômica de los Simúlidos (Diptera: Nematocera) de Venezuela, com
descrpción de diez espécies nuevas. Acta Biol.Venez. 7(3):271-372.
RAMIREZ-PEREZ; YARZABAL,L. & PETERSON,B. (1982) –
La Simulidofauna Del Território Federal Amazonas (Venezuela). Ediciones PROICET
AMAZONAS, Publicación Cientifica num. 1, 104pp.
REY,L. (1992) – Bases da Parasitologia Médica. 2a
edição. Editora Guanabara Koogan, Rio de Janeiro, 731p.
RIVER BLINDNESS FOUNDATION (RBF) – (1993) – Onchocerciasis on River
Blindness. A Technical review for Health Professional and Scientist. External
Affairs Office, Boston, USA. 16p.
ROSS,D.H. &
MERRIT,R.W. (1978) – The larval instar and population dynamics of five species
of black flies (Diptera:Simuliidae) and their responses to select environmental
factor. Can.J.Zool 56 (10): 1633-1642.
ROSS,D.H. &
CRAIG,D.A. (1979) – Trhe seven larval instar of Prosimulium mixtum Syme
and Davies and P. fuscum Syme and Davies (Diptera:Simuliidae). Can.J.Zool.
57(2): 290-300.
ROSS,D.H. (1979)
– The larval instars of the black flies Stegoptera mutata and Simulium
vittatum (Diptera:Simuliidae).Can.Ent. 111: 693-697.
SANTOS-NETO,C.R.;
HAMADA,N.; COUCEIRO,S.R.M. (2015) – Bionomic of Black Fly Simulium guianense
(Diptera:Simuliidae) in Northeast Brazil. Florida Entomologist 98 (2): 446-450.
SHELLEY,A.J.
(1994) – Factors Affecting Filarial Transmission by simuliids. Advances in
Diseases Vector Research, 10: 183-213.
SHELLEY,A.J.;
LOWRY,C.A.; MAIA-HERZOG,M; LUNA DIAS,A.P.A.; MORAES,M.A.P. (1997) – Biosystematic
studies on the Simuliidae (Diptera) of the Amazonia onchocerciasis focus.
Bull.Nat.Hist.Mus.Lond (Ent.). 66(1):1-121p.
SILVA,A.N.B. (2006) – Estádios larvais e ocorrência
sazonal de imaturos de Psaroniocompsa incrustata (Lutz,1910)
(Diptera:Simuliidae) no rio Pium, Municipio de Nísia Floresta, Rio Grande do
Norte. Dissertação de Mestrado, Universidade Federal do Rio Grande do Norte,
Pós Graduação em Bioecologia Aquática, Natal. 72pp.
SOUZA,M.A.T. (1984) –
Atendimento médico por picadas de simulídeos. Bol.saúde. Porto Alegre, 11(2):
9-11.
TAVARES, A.S. (1997) –
Podostemaceae de alguns rios de água preta do Estado do Amazonas. Tese de
Doutorado.Instituto Nacional de Pesquisas da Amazônia (INPA/CPBO), Manaus,
Amazonas, 216p.
WIGGLESWORTH,V.G. (1961) – The Principles of
Insect Physiology. Chapman & Hall, seventh edition, Inglaterra, 827p.













































Nenhum comentário:
Postar um comentário